Günümüzde bilinen yaklaşık olarak 120 adet element vardır; ancak periyodik cetveldeki 8A Grubundaki elementler hariç diğerleri kararsızdır. 8A Grubundaki elementler yani Soygazlar adı verilen elementler kararlı (az enerjiye sahip) yapıya sahiptir. Yani son yörüngeleri tamamen elektron doludur. Bu nedenle elektron alış-verişi yapma eğiliminde değildirler çünkü denge durumundadırlar. (Konuyla ilgili detaylı bilgi edinmek için Elementlerin Periyodik Tablodaki Yerinin Bulunması adlı yazımızı inceleyebilirsiniz.)
Soygazlar dışındaki bu elementler elektron dizilimlerini kararlı yapıdaki soygazlara benzetebilmek için elektron alırlar, verirler veya ortaklaşa kullanırlar. Böylece aralarında kimyasal bağlar oluşur.
Bilimsel olarak “Kimyasal bağ, atomları birbirine bağlayan ve atomların birarada kalmalarını sağlayan kuvvetlere verilen addır.” şeklinde tanımlayabiliriz.
Kimyasal bağlar, iyonik bağ ve kovalent bağ olmak üzere ikiye ayrılır.
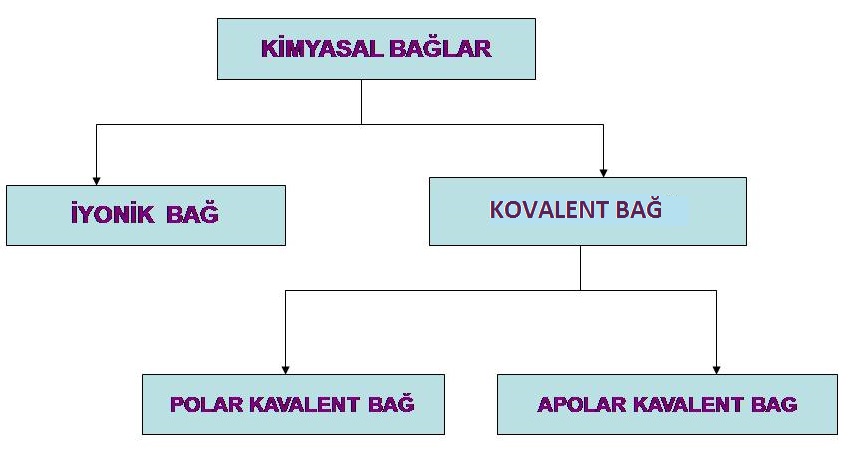
İyonik Bağlar
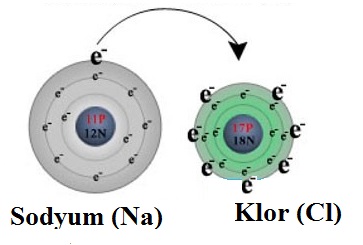 Metaller kararlı yapıya ulaşmak için elektron verirken ametaller elektron alırlar. Metal ve ametal elementler arasında elektron alış-verişi sonucunda oluşan kimyasal bağa iyonik bağ denir.
Metaller kararlı yapıya ulaşmak için elektron verirken ametaller elektron alırlar. Metal ve ametal elementler arasında elektron alış-verişi sonucunda oluşan kimyasal bağa iyonik bağ denir.
Başka bir deyişle;
İyonik bağ, elektronlar bir atomdan diğerine aktarıldığı zaman meydana gelen bağlara verilen addır. Tepkimeye giren elementlerden birinin atomları, elektron kaybedip pozitif yüklü iyonlara (katyonlara) dönüşürken, diğer elementin atomları elektron kazanıp negatif yüklü iyonları (anyonları) oluştururlar. Böylece zıt (artı-eksi) bir şekilde yüklenmiş iyonlar oluşur. Bu zıt yüklü iyonlar arasındaki elektrostatik çekim kuvveti iyonik bağı oluşturur ve bu bağ, söz konusu iyonları bir kristal içinde tutar.
Örnek:
İyonik Yapılı Bazı Bileşikler
NaCl
Mg3P2
AlCl3
CaF2
Kovalent Bağlar
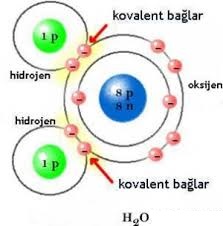
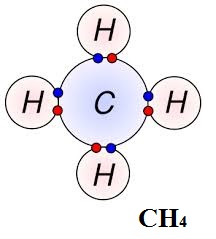
Ametal – ametal atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa denir. Ametaller elektron almaya yatkındırlar; bu nedenle elektron alışverişi yapamazlar ve elektronları ortaklaşa kullanırlar. Bu şekilde elektronlarını ortaklaşa kullanarak oktetlerini veya dubletlerini tamamlamış olurlar.
- Kovalent bağ, aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Örnek:
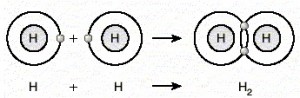
- Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır.
Örnek:
Örnek:
Kovalent Bağlı Bazı Bileşikler
H2O,
CO2,
N2O5,
CH4
Dublet ve Oktet Kuralı
Dublet Kuralı; Atomların elektron katman dizilimlerini helyumun elektron dizilimine benzetme kuralıdır.
Sadece H, Li, Be, B ile istisnai durumlarda C atomları bu kurala uyar. Helyum tek elektron katmanına sahiptir ve bu katman alabileceği maksimum elektron sayısı olan 2 elektrona sahiptir.
Oktet Kuralı; Atomların elektron katman dizilimlerini helyum dışındaki soy gazların elektron dizilimine benzetme kuralıdır. Helyum dışındaki soy gazların son yörüngesinde 8 elektron bulunur. Atomlar elektron alarak, vererek veya ortaklaşa kullanarak kararlı hale elmek isterler.
Konu hakkında detaylı bilgi edinmek için aşağıdaki yazılarımızı inceleyebilirsiniz.
Maddenin Yapısı ve Özellikleri
Elementler ve Kullanım Alanları
Elementlerin Sınıflandırılması-Metaller, Ametaller, Yarı Metaller ve Soygazlar
Elementlerin Periyodik Tablodaki Yerinin Bulunması
Periyodik Tablo ve Özellikleri
Periyodik Cetvelin Özelliklerinin Değişimi
Bileşiklerin Adlandırılması ve Bileşiklerin Yapısındaki Atom Sayısının Bulunması
Asitler, Bazlar ve Tuzların Özellikleri