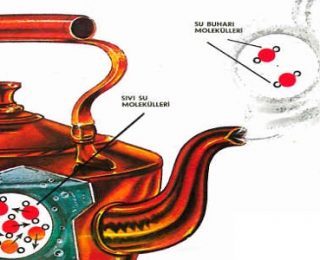
Maddelerin katı, sıvı ve gaz olarak sınıflandırılmasının 3 temel nedeni vardır:
- Tanecikler arası mesafe
- Taneciklerin hızı
- Tanecikler arası çekim kuvveti
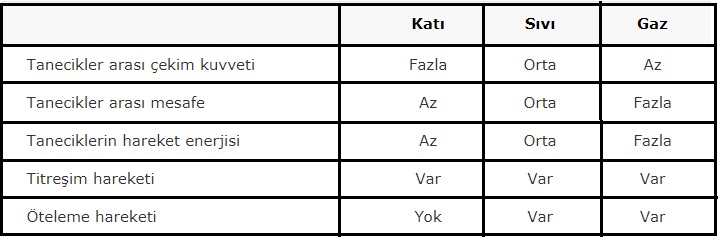
Yukarıdaki tablodan da anlaşılacağı üzere ;
tanecikler arası bağ; katıdan gaza doğru zayıflarken, gazdan katıya doğru kuvvetlenir.
taneciklerin hızı; katıdan gaza doğru artarken, gazdan katıya doğru azalır.
tanecikler arası mesafe; katıdan gaza doğru artarken, gazdan katıya doğru azalır.
düzensizlik; katıdan gaza doğru artarken, gazdan katıya doğru azalır.
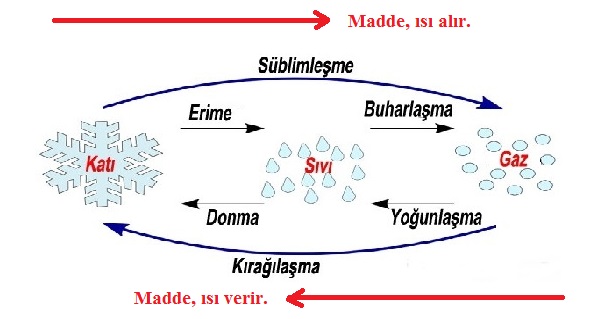
Erime ve Donma Isısı
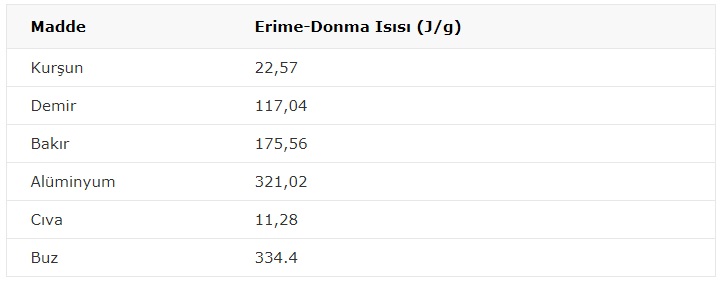
**Erime sıcaklığındaki 1 gram katı maddeyi tamamen sıvı hale getirmek için gerekli ısıya erime ısısı denir. Erime ısısı, maddeler için ayırt edici bir özelliktir.
m (1 gramdan farklı bir kütle için) kütleli katı bir maddenin erime ısısı Q=m.Le formülü ile hesaplanır.
Q: 1 gramdan farklı bir kütle için verilen ısı – Birimi kalori (cal)
m: kütle – Birimi gram (g)
Le: 1 gram katı madde için Erime Isısı – Birimi cal/g
Örnek: Buz için Le: 80 cal/g olduğuna göre 5 g. buzu eritmek için kaç cal ısı gerekir?
Q=m.Le
Q=5.80 = 400 cal
**Donma sıcaklığındaki 1 gram sıvı maddeyi tamamen katı hale getirmek için gerekli ısıya donma ısısı denir.
Donma ısısı, maddeler için ayırt edici bir özelliktir.
m (1 gramdan farklı bir kütle için) kütleli sıvı bir maddenin donma ısısı Q=m.Ld formülü ile hesaplanır.
Q: 1 gramdan farklı bir kütle için maddenin dışarıya verdiği ısı – Birimi kalori (cal)
m: kütle – Birimi gram (g)
Ld: 1 gram sıvı madde için Donma Isısı – Birimi cal/g
Not: Aynı maddenin donma ısısı ve erime ısısı birbirine eşit niceliktedir.
Buz için erime ısısı Le: 80 cal/g iken
Su için donma ısısı Ld: 80 cal/g ‘dır.
Not: Bir saf sıvıda başka bir madde çözündüğünde sıvının donma sıcaklığı düşer. Bu nedenle kışın yapılan tuzlama işlemiyle donmaktası düşürülmüş olur ve yolların buzlanması önlenir.
Buharlaşma ve Kaynama Isısı
**Kaynama sıcaklığındaki 1 gram sıvı maddeyi tamamen gaz hale getirmek için sıvıya verilmesi gereken ısıya buharlaşma ısısı denir.
Buharlaşma ısısı, maddeler için ayırt edici bir özelliktir.
m (1 gramdan farklı bir kütle için) kütleli sıvı bir maddenin buharlaşma ısısı Q=m.Lb formülü ile hesaplanır.
Q: 1 gramdan farklı bir kütle için verilen ısı – Birimi kalori (cal)
m: kütle – Birimi gram (g)
Lb: 1 gram sıvı madde için Buharlaşma Isısı – Birimi cal/g
**Yoğuşma sıcaklığındaki 1 gram gaz maddeyi tamamen sıvı hale getirmek için gaz maddenin dışarıya vermesi gereken ısıya yoğuşma ısısı denir.
Yoğuşma ısısı, maddeler için ayırt edici bir özelliktir.
m (1 gramdan farklı bir kütle için) kütleli gaz bir maddenin yoğuşma ısısı Q=m.Ly formülü ile hesaplanır.
Q: 1 gramdan farklı bir kütle için maddenin dışarı verdiği ısı – Birimi kalori (cal)
m: kütle – Birimi gram (g)
Lb: 1 gram sıvı madde için Buharlaşma Isısı – Birimi cal/g
Not 1: Aynı maddenin buharlaşma ve yoğuşma ısısı birbirine eşit niceliktedir.
Su için Lb: 540 cal/g
Su buharı için Ly: 540 cal/g
Not 2: Bir saf sıvıda başka bir madde çözündüğünde sıvının kaynama sıcaklığı yükselir.
Not 3: Deniz seviyesinden yükseklere çıktıkça sıvının kaynama noktası düşer. Bunun sebebebi açık hava basıncının (Po’ın) azalmasıdır. Bu sebeple kaynama süresi de kısalır.
Not 4: Bir kabın ağzı kapalı iken sıvı daha kısa sürede kaynar. Örneğin; düdüklü tencerede yemeğin daha kısa sürede pişmesi.