Bileşiklerdeki Atom Sayısının Bulunması
Bileşiklerdeki elementlerin alt köşesinde yazan sayılar, bileşiği oluşturan elementlerin sayısını verir. Yani o bileşikte kaç tane o elementten bulunduğunu gösterir. Daha iyi anlaşılması için aşağıdaki örnekleri inceleyelim:
Örnek:
Al2O3: 2 tane Alüminyum ve 3 tane Oksijen olmak üzere toplam 5 atom içerir.
MgBr2: 1 tane Magnezyum ve 2 tane Brom (Br) olmak üzere toplam 3 atom içerir.
MgCO3: 1 tane Magnezyum, 1 tane Karbon ve 3 tane Oksijen olmak üzere toplam 5 atom içerir.
Ca(NO3)2: 1 tane Kalsiyum, 1×2=2 tane Azot (N) ve 3×2=6 tane Oksijen olmak üzere toplam 9 atom içerir.
Fe2(CO3)3: 2 tane Demir (Fe), 1×3=3 tane Karbon ve 3×3=9 tane Oksijen olmak üzere toplam 14 atom içerir.
Ba3(PO4)2: 3 tane Baryum (Ba), 1×2=2 tane Fosfor (P) ve 2×4=8 Oksijen olmak üzere toplam 13 atom içerir.
(NH4)3PO4: 1×3=3 tane Azot (N), 3×4=12 tane Hidrojen, 1 tane Fosfor ve 4 tane Oksijen olmak üzere toplam 20 atom içerir.
Bileşiklerin Adlandırılması
Daha önce bileşikleri nasıl iyonik ve kovalent yapılı olmak üzere ayırt edeceğimizi öğrenmiştik. Bununla ilgili detaylı bilgi edinmek için Kimyasal Bağ Nedir? Çeşitleri Nelerdir? adlı yazımızı tıklayıp inceleyebilirsiniz.
1. İyonik Yapılı Bileşiklerin Adlandırılması
Bu metal ile ametalden oluşan bileşiklerin adlandırılmasıdır.
Metalin Adı + Ametalin Adı + “-ür eki”
Örnek:
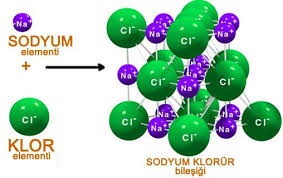
NaCl: Sodyum klorür
KF: Potasyum florür
CaI2: Kalsiyum iyodür
MgBr2: Magnezyum bromür
1. NOT: Eğer bileşiği oluşturan ametal oksijen (O) ise oksit, azot (N) ise nitrür, kükürt (S) ise sülfür ve hidrojen (H) ise hidrür şeklinde okunur.
Al2O3: Alümnyum oksit
Ca3N2: Kalsiyum nitrür
ZnS: Çinko sülfür
LiH: Lityum hidrür
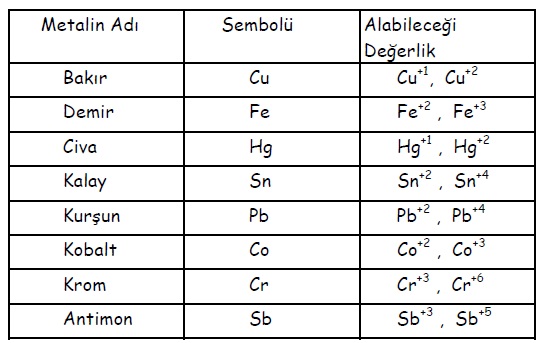
2. NOT: Eğer metalin birden fazla değerliği varsa bu durumda metalin bileşikteki değerliği ne ise o eğerlik metalin adından sonra parantez içinde belirtilir.
Birden fazla değerliğe sahip metallere örnekler:
Örneğin demir (Fe), bileşiklerinde hem +3, hem de +2 değerliği alabildiği için
FeCl3: Demir (III) klorür
FeCl2: Demir (II) klorür
2. Kovalent Yapılı Bileşiklerin Adlandırılması
İki ametalden oluşan bileşiklerin adlandırılmasıdır. Bu bileşikler adlandırılırken latince sayıları 10’a kadar bilmek gerekir.
1: mono
2: di
3: tri
4: tetra
5: penta
6: hekze
7: hepta
8: okta
9: nona
10: deka
1. Ametalin Sayısı + 1. Ametalin Adı + 2. Ametalin Sayısı + 2. Ametalin Adı + “-ür eki”
(1. Ametalin sayısı “1” ise yazılmaz ve okunmaz. Ancak 2. Ametalin sayısı “1” ise “mono” şeklinde mutlaka okunur.)
Örnek:
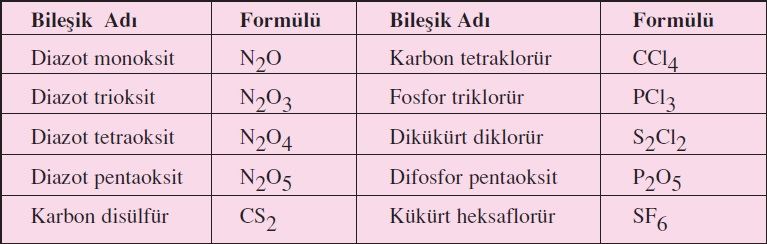
CO: Karbon Monoksit
CO2: Karbon dioksit
N2O: Di azot monoksit
3. Kök İçeren Bileşiklerin Adlandırılması
Bazı çok atomlu iyonlar vardır. Bunlara kökler denir. Bilinmesi gereken bazı önemli kökler aşağıdaki gibidir.
3.a) Metal ve Kökten Oluşan Bileşikler
Bilindiği üzere metaller pozitif yüklü oldukları için bu bileşiklerdeki kökler anyondur yani negatif (-) yüklü iyon şeklindedir.
Metalin Adı + Kökün Adı
Li2CO3: Lityum Karbonat
K2SO4: Potasyum sülfat
Mg3(PO4)2: Magnezyum fosfat
Ca(NO3)2: Kalsiyum nitrat
3.b) Kök ve Ametalden Oluşan Bileşikler
Bu bileşikteki kök ise katyondur yani pozitif (+) yüklü iyon şeklindedir.
Kökün Adı + Ametalin Adı + “-ür eki”
NH4F: Amonyum florür
(NH4)2S: Amonyum sülfür
3.c) İki Kökten Oluşan Bileşikler
1. Kökün Adı + 2. Kökün Adı
(NH4)3 PO4: Amonyum fosfat
NH4OH: Amonyum hidroksit
Maddenin Yapısı ve Özellikleri
Elementler ve Kullanım Alanları
Elementlerin Sınıflandırılması-Metaller, Ametaller, Yarı Metaller ve Soygazlar
Elementlerin Periyodik Tablodaki Yerinin Bulunması
Periyodik Tablo ve Özellikleri
Periyodik Cetvelin Özelliklerinin Değişimi
Kimyasal Bağ Nedir? Çeşitleri Nelerdir?
Asitler, Bazlar ve Tuzların Özellikleri
Asitler ve Bazların Kullanım Alanları
Asit Yağmurları ve Çevreye Etkileri