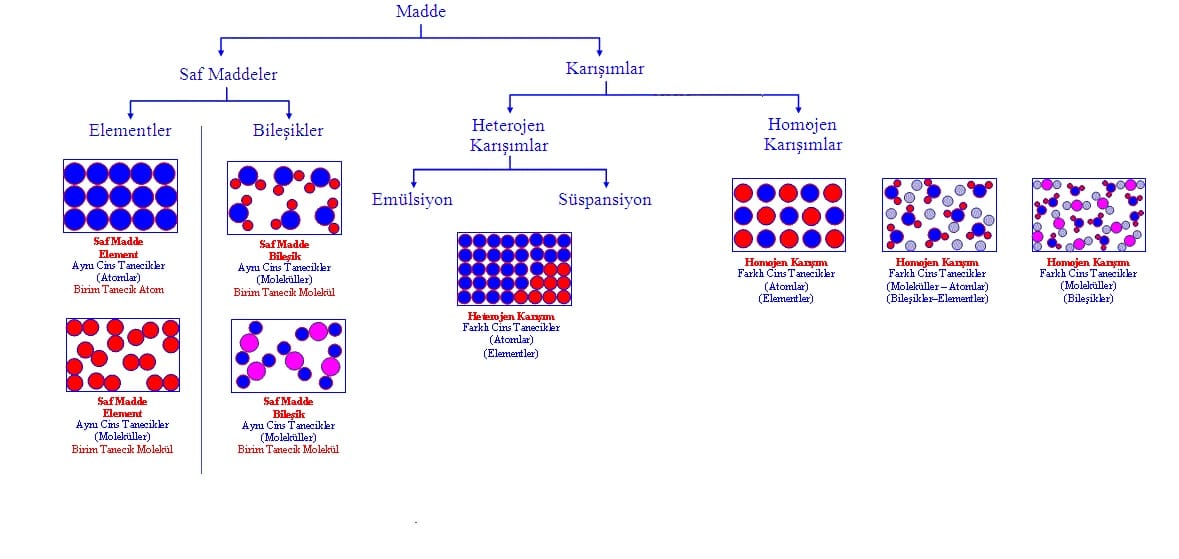
Madde: Kütlesi, hacmi, eylemsizliği ve tanecikli yapısı olan her şeye madde denir. Madde; katı, sıvı ve gaz olarak fiziksel hallerine göre sınıflandırılır.
 Saf Maddeler
Saf Maddeler
Özellikleri
1. Aynı cins atom ya da moleküllerden oluşurlar.
2. Sabit basınçta erime ve kaynama noktaları değişmez.
3. Kendine özgü ayırt edici özellikleri ( erime, donma, kaynama noktası, yoğunlaşma vb.) vardır.
4. Yapıları homojendir.
5. Fiziksel yöntemlerle kendilerinden farklı türde daha basit maddelere ayrışmazlar.
Saf maddeler, elementler ve bileşikler olarak 2 grupta incelenirler.
Elementler
* Aynı cins atomlardan oluşur.
* En basit saf maddelerdir.
* Element özelliği gösteren en küçük tanecik atomdur.
* Fiziksel veya kimyasal yöntemlerle kendinden daha basit maddelere ayrışmazlar.
* Sabit basınç altında erime, kaynama, donma noktası, özkütlesi (yoğunluğu) bellidir.
* Sembollerle gösterilirler.
Sembol: Elementleri simgelemek için kullanılırlar. Latince isimlerinin ilk harfi elementin sembolüdür. İsimlerinin ilk harfi aynı olan birden çok element varsa sonraki harf de kullanılır. İlk harf büyük, ikinci harf küçük yazılır. Semboller, bütün dillerde aynıdır.
Örnek: C (Karbon), Ca (Kalsiyum), Cu (Bakır), N (Azot), Na (Sodyum), O (Oksijen), F (Flor), Fe (Demir)
Bileşikler
* Farklı cins atomlardan ve aynı cins moleküllerden oluşurlar.
* Bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır.
* Daha basit maddelere fiziksel yöntemlerle ayrışamazlar ancak kimyasal yollarla ayrışabilirler.
* Bileşiği oluşturan maddeler kendi özelliklerini kaybeder.
Örnek: Hidrojen (H) yanıcı, Oksijen (O) yakıcı, bunların birleşiminden oluşan Su (H2O) ise söndürücü özelliktedir.
* Sabit basınç altında erime, kaynama, donma noktası, özkütlesi (yoğunluğu) sabittir.
* Formüllerle gösterilirler.
Formül: Molekülü oluşturan atomların türünü ve atomların moleküldeki sayılarını gösteren yapıdır.
Örnek:
Sembol: H, O, Cl
Element moleküllerinin formülle gösterilmesi: H2, O2, Cl2
Bileşik moleküllerinin formülle gösterilmesi: H2O, CO2, HCl, H2SO4, NaOH
Bileşiklerin Formülleri ile ilgili detaylı bilgi edinmek için “Bileşikler ve Formülleri” adlı yazımızı inceleyebilirsiniz.
Karışımlar
Birden fazla maddenin (element veya bileşiğin) tanecik yapılarını değiştirmeden oluşturduğu maddelere karışım adı verilir.
* Farklı cins atom ve moleküllerden oluşur.
* Saf değillerdir.
* Belli formülleri yoktur.
* Karışımı oluşturan maddeler arasında belirli oran yoktur. Her oranda karışabilirler.
* Karışımı oluşturan maddeler özelliklerini kaybetmezler.
* Fiziksel ve kimyasal yöntemlerle (süzme, eleme, damıtma gibi) kendini oluşturan daha basit yapılı bileşenlerine ayrışabilirler.
* Sabit bir özkütlesi (yoğunluğu) yoktur.
* Belirli bir erime, kaynama, donma noktası yoktur.
* Homojen ve heterojen olmak üzere 2 çeşittir.
Heterojen Karışımlar
 Karışımı oluşturan maddeler birbiri içerisinde düzgün olarak dağılmıyorsa böyle karışımlara heterojen karışımlar denir. Heterojen karışımlar, dışarıdan bakıldığında tek bir madde gibi görünmezler.
Karışımı oluşturan maddeler birbiri içerisinde düzgün olarak dağılmıyorsa böyle karışımlara heterojen karışımlar denir. Heterojen karışımlar, dışarıdan bakıldığında tek bir madde gibi görünmezler.
Örnek:
Tebeşirli su, kumlu su, talaşlı su, yağlı su, salata, ayran gibi karışımlar heterojendir.
Homojen Karışımlar (Çözeltiler)
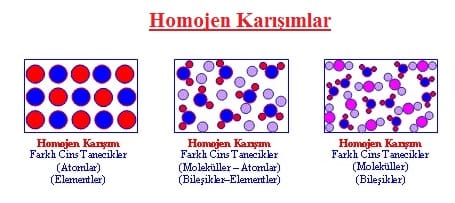 Karışımı oluşturan maddeler birbiri içerisinde düzgün olarak dağılıyorsa böyle karışımlara homojen karışımlar (çözeltiler) denir. Homojen karışımlar, dışarıdan bakıldığında tek bir madde gibi görünürler.
Karışımı oluşturan maddeler birbiri içerisinde düzgün olarak dağılıyorsa böyle karışımlara homojen karışımlar (çözeltiler) denir. Homojen karışımlar, dışarıdan bakıldığında tek bir madde gibi görünürler.
Örnek:
Tuzlu su, limonata, kolonya, alkollü su, kol, hava, tuzlu su, gazoz
Konu hakkında detaylı bilgi edinmek için aşağıdaki yazılarımızı inceleyebilirsiniz.
Elementler ve Kullanım Alanları
Elementlerin Sınıflandırılması-Metaller, Ametaller, Yarı Metaller ve Soygazlar
Elementlerin Periyodik Tablodaki Yerinin Bulunması
Periyodik Tablo ve Özellikleri
Periyodik Cetvelin Özelliklerinin Değişimi
Kimyasal Bağ Nedir? Çeşitleri Nelerdir?
Bileşiklerin Adlandırılması ve Bileşiklerin Yapısındaki Atom Sayısının Bulunması
Asitler, Bazlar ve Tuzların Özellikleri