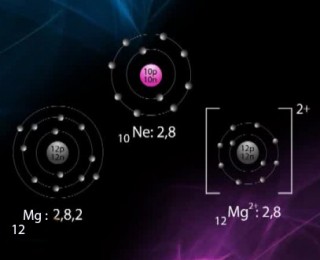
Soygazlar dışındaki elementler, kararlı olan soygaz elektron düzenine ulaşmak için elektron alış verişi yapar ya da ortaklaşa elektron kullanırlar. Bu şekilde pozitif veya negatif yüklü atom ya da atom grupları oluşur. (+) yüklü (katyon) veya (-) yüklü (anyon) olan bu atom ya da atom gruplarına iyon denir.
iyon yükü = proton sayısı – elektron sayısı şeklinde hesaplanır.
(Elementlerin elektron dağılımıyla ilgili detaylı bilgi için Elementlerin Periyodik Tablodaki Yerinin Bulunması yazımızı inceleyebilirsiniz.)
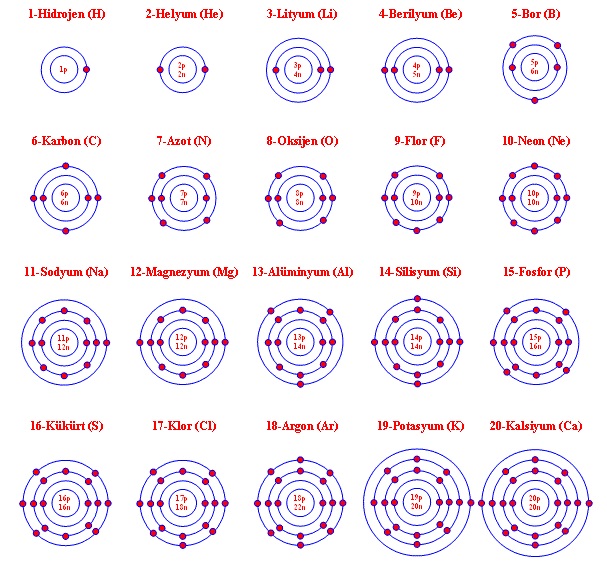
Metaller elektron vermeye, ametaller ise elektron almaya yatkındır. Bu nedenle metaller bileşiklerinde pozitif değerlik alırlar, ametaller ise hem pozitif hem de negatif değerlik alabilirler. Periyodik cetveldeki ilk 20 element ve aldıkları değerlikler (iyon yükleri) aşağıdaki gibidir:
1. Hidrojen (H)
Periyodik Cetveldeki Yeri: 1. periyot, 1A Grubu
Element Türü: Ametal
İyon Yükü: Tüm bileşiklerinde +1 yüklü; yalnız metallerle yaptıkları bileşiklerde (Hidrürlerde: NaH, KH gibi) -1 yüklü.
2. Helyum (He)
Periyodik Cetveldeki Yeri: 1. periyot, 8A Grubu (Dikkat:2A değil!)
Element Türü:Soygaz
İyon Yükü: Kararlıdır, bileşik yapmaz. Tek atomlu, nötr halde doğada bulunur.
3. Lityum (Li)
Periyodik Cetveldeki Yeri: 2. periyot, 1A Grubu
Element Türü: Metal
İyon Yükü: +1
4. Berilyum (Be)
Periyodik Cetveldeki Yeri: 2. periyot, 2A Grubu
Element Türü: Metal
İyon Yükü: +2
5. Bor (B)
Periyodik Cetveldeki Yeri: 2. periyot, 3A Grubu
Element Türü: Yarı metal
İyon Yükü: +3
6. Karbon (C)
Periyodik Cetveldeki Yeri: 2. periyot, 4A Grubu
Element Türü: Ametal
İyon Yükü: +4, -4
7. Azot (N)
Periyodik Cetveldeki Yeri: 2. periyot, 5A Grubu
Element Türü: Ametal
İyon Yükü: +5, …, -3
8. Oksijen (O)
Periyodik Cetveldeki Yeri: 2. periyot, 6A Grubu
Element Türü: Ametal
İyon Yükü: +2, +1, -1, -2
9. Flor (F)
Periyodik Cetveldeki Yeri: 2. periyot, 7A Grubu
Element Türü: Halojen
İyon Yükü: Elektron alma isteği (elektronegatifliği) çok yüksektir. Elektron vermez, yalnızca -1 değerlikli olabilir.
10. Neon
Periyodik Cetveldeki Yeri: 2. periyot, 8A Grubu
Element Türü: Soygaz
İyon Yükü: Kararlıdır, bileşik yapmaz. Tek atomlu, nötr halde doğada bulunur.
11. Sodyum (Na)
Periyodik Cetveldeki Yeri: 3. periyot, 1A Grubu
Element Türü: Metal
İyon Yükü: +1
12. Magnezyum (Mg)
Periyodik Cetveldeki Yeri: 3 periyot, 2A Grubu
Element Türü: Metal
İyon Yükü: +2
13. Alüminyum (Al)
Periyodik Cetveldeki Yeri: 3 periyot, 3A Grubu
Element Türü: Metal
İyon Yükü: +3
14. Silisyum (Si)
Periyodik Cetveldeki Yeri: 3 periyot, 4A Grubu
Element Türü: Yarı metal
İyon Yükü: +4, -4
15. Fosfor (P)
Periyodik Cetveldeki Yeri: 3 periyot, 5A Grubu
Element Türü: Ametal
İyon Yükü: +5, …, -3
16. Kükürt (S)
Periyodik Cetveldeki Yeri: 3 periyot, 6A Grubu
Element Türü: Ametal
İyon Yükü: +6, …, -2
17. Klor (Cl)
Periyodik Cetveldeki Yeri: 3 periyot, 7A Grubu
Element Türü: Halojenler
İyon Yükü: +7, …, -1
18. Argon (Ar)
Periyodik Cetveldeki Yeri: 3 periyot, 8A Grubu
Element Türü: Soygazlar
İyon Yükü: Kararlıdır, bileşik yapmaz. Tek atomlu, nötr halde doğada bulunur.
19. Potasyum (K)
Periyodik Cetveldeki Yeri: 4. periyot, 1A Grubu
Element Türü: Metal
İyon Yükü: +1
20. Kalsiyum (Ca)
Periyodik Cetveldeki Yeri: 4. periyot, 2A Grubu
Element Türü: Metal
İyon Yükü: +2
Konu hakkında detaylı bilgi edinmek için aşağıdaki yazılarımızı inceleyebilirsiniz.
Maddenin Yapısı ve Özellikleri
Elementler ve Kullanım Alanları
Elementlerin Sınıflandırılması-Metaller, Ametaller, Yarı Metaller ve Soygazlar
Elementlerin Periyodik Tablodaki Yerinin Bulunması
Periyodik Tablo ve Özellikleri
Periyodik Cetvelin Özelliklerinin Değişimi
Kimyasal Bağ Nedir? Çeşitleri Nelerdir?
Bileşiklerin Adlandırılması ve Bileşiklerin Yapısındaki Atom Sayısının Bulunması
Asitler, Bazlar ve Tuzların Özellikleri